Autora: Julia Alonso
Lo que comenzó como una promesa científica se ha convertido hoy en una revolución clínica gracias al desarrollo de las CAR-T (células T con receptor de antígeno quimérico). Sin embargo, más allá de su impacto clínico, estas terapias plantean importantes retos económicos y de equidad: ¿son sostenibles para los presupuestos públicos?, ¿tienen todos los pacientes la misma posibilidad de acceso?
¿Qué son las CAR-T?
El tratamiento con CAR-T es un procedimiento de inmunoterapia avanzada en el que los linfocitos T del propio paciente se extraen y se modifican genéticamente para reconocer y destruir células tumorales, y posteriormente se vuelven a administrar al paciente (procedimiento conocido científicamente como aféresis). Han demostrado resultados muy relevantes en leucemias y linfomas, en pacientes con mal pronóstico y opciones terapéuticas limitadas (1,2). La supervivencia global se sitúa en torno al 78 % a los 6 meses y al 52 % a los 18 meses. No obstante, estos resultados dependen del tipo de cáncer tratado, del antígeno diana y del CAR-T específico, así como de las características de los pacientes (3).
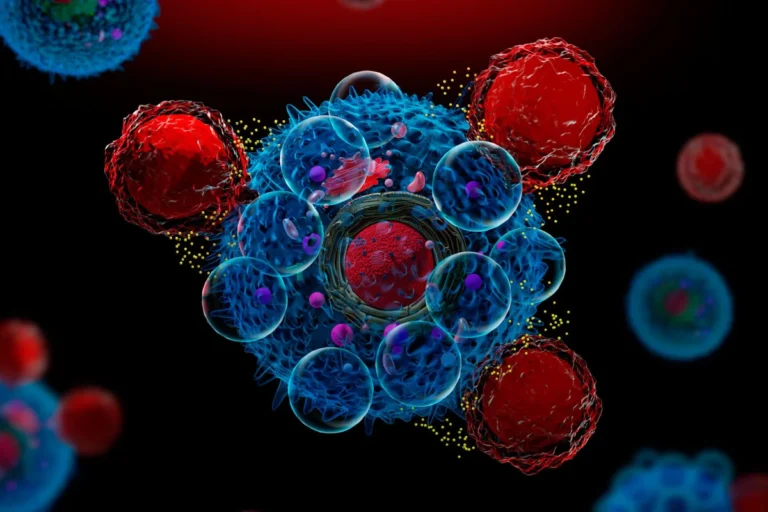
Figura 1. CAR-T atacando a una célula cancerosa.
Fuente: El Mundo (4).
Como es de esperar, la innovación tiene un precio. En España, las terapias CAR-T comerciales disponibles (Kymriah®, Yescarta®, Tecartus®, Abecma® o Carvykti®) pueden superar los 300.000 € por paciente y tratamiento, sin incluir costes asociados a hospitalización, cuidados intensivos y manejo de efectos adversos (5).
En respuesta a este elevado impacto económico, la incorporación de las CAR-T al sistema sanitario ha impulsado la adopción de modelos de financiación innovadores, como los acuerdos de pago por resultados, orientados a compartir riesgos y limitar la presión presupuestaria (6). Además, requieren sistemas de medición y seguimiento en práctica clínica real (p. ej., VALTERMED) para monitorizar los resultados en salud y garantizar un uso eficiente de los recursos (7).
CAR-T académicas: una alternativa pública
Desde la sanidad pública española han surgido respuestas innovadoras complementarias a las CAR-T comerciales. Mientras que las CAR-T de fabricación industrial autorizados por la Comisión Europea son desarrollados por grandes compañías farmacéuticas, a gran escala y bajo procesos estandarizados, pasando por rigurosos ensayos clínicos, y permiten tratamientos uniformes y accesibles para las indicaciones específicas indicadas; las CAR-T académicas surgen desde hospitales universitarios y centros públicos, a menudo bajo la cláusula de exención hospitalaria, permitiendo personalizarse más y dirigirse a dianas diferentes, en menos tiempo y con menor coste (8). El Hospital Clínic de Barcelona ha desarrollado terapias CAR-T académicas, como ARI-0001 y ARI-0002h, ya aprobadas por la AEMPS, mientras otros hospitales trabajan en nuevas propuestas. Estas terapias reducen de forma significativa los costes de fabricación y financiación—en el caso de ARI-0001 el PVL es de 89.000 € por paciente— y abren la puerta a modelos más sostenibles y equitativos (5,9).
Acceso desigual entre comunidades autónomas
Pese a estos avances, el acceso a las CAR-T sigue siendo desigual en España. Aunque la mayoría de las comunidades cuentan con centros autorizados, otras como Castilla-La Mancha, Extremadura o La Rioja no disponen de ellos, obligando a derivar pacientes a otras regiones (10). Sin embargo, esta derivación no siempre garantiza un acceso efectivo al tratamiento (11). Los desplazamientos, los tiempos de espera, la complejidad administrativa y los costes indirectos asociados pueden convertirse en barreras reales que limitan las opciones terapéuticas de estos pacientes, poniendo en cuestión si el lugar de residencia condiciona, en la práctica, la posibilidad de recibir una terapia potencialmente curativa.
Reflexión final sobre los retos y oportunidades de las CAR-T
Las CAR-T representan un salto revolucionario en la medicina, ofreciendo esperanza donde antes había pocas opciones. La ciencia continúa avanzando, y actualmente se están desarrollando las CAR-T Tándem, así como se está valorando la posibilidad de desarrollar CAR-T ambulatorios (12). Sin lugar a duda, los principales retos siguen siendo la investigación, el desarrollo, la financiación, la inversión en infraestructuras, la formación y la fijación de un marco regulatorio adecuado. Pero todo ello constituye una enorme oportunidad: la de salvar vidas.
Cabe cerrar este artículo con una reflexión final sobre el valor social que podrían llegar a generar las CAR-T. Si consideráramos los ahorros de costes de pérdidas de productividad laboral de pacientes y sus cuidadores, los AVACs ganados y las muertes prematuras evitadas debidos al tratamiento, posiblemente obtendríamos un impacto social que justificaría sobradamente la inversión.
Referencias
1. Zhang X, Zhu L, Zhang H, Chen S, Xiao Y. CAR-T Cell Therapy in Hematological Malignancies: Current Opportunities and Challenges. Front Immunol. 2022;13:927153.
2. Bharadia H, Dabhade A, Shah AC, Patel R, Chorawala MR, Patel A, et al. CAR T-cell immunotherapy as the next horizon in cancer eradication: current landscape, challenges, and future directions. Med Oncol. 6 de agosto de 2025;42(9):410.
3. Wang V, Gauthier M, Decot V, Reppel L, Bensoussan D. Systematic Review on CAR-T Cell Clinical Trials Up to 2022: Academic Center Input. Cancers. enero de 2023;15(4):1003.
4. Barcelona MR. ELMUNDO. 2023 [citado 16 de diciembre de 2025]. Terapias CAR-T y tumores sólidos: primeros resultados positivos. Disponible en: https://www.elmundo.es/ciencia-y-salud/salud/2023/12/02/656a0a4efdddff06288b4572.html
5. www.ocu.org [Internet]. [citado 16 de diciembre de 2025]. Terapias oncológicas avanzadas : la primera CAR-T pública. Disponible en: https://www.ocu.org/salud/medicamentos/noticias/terapia-cart-publica
6. Ministerio de Sanidad. Ministerio de Sanidad – Profesionales de la Salud – Buscador situación financiación medicamentos [Internet]. [citado 17 de diciembre de 2025]. Disponible en: https://www.sanidad.gob.es/profesionales/medicamentos.do
7. Ministerio de Sanidad. Ministerio de Sanidad – Profesionales – VALTERMED: Resultados en salud [Internet]. [citado 17 de diciembre de 2025]. Disponible en: https://www.sanidad.gob.es/areas/farmacia/infoMedicamentos/valtermed/
8. Grupo Español de Transplante Hematopoyético y Terapia Celular. CART [Internet]. 2020 [citado 17 de diciembre de 2025]. Disponible en: https://www.geth.es/component/content/article/226-cart-cells/609-cart-industrial-y-academico
9. Delgado J, Juan M, Calvo G, Urbano-Ispizua Á. The development of academic CAR T cells. The Lancet Haematology. 2024;11(7):e484-5.
10. Ministerio de Sanidad. Ministerio de Sanidad – Áreas – Terapias Avanzadas en el Sistema Nacional de Salud (SNS) [Internet]. [citado 16 de diciembre de 2025]. Disponible en: https://www.sanidad.gob.es/areas/farmacia/infoMedicamentos/terapiasAvanzadas/home.htm?utm_source=copilot.com
11. SEHH (Sociedad Española de Hematología y Hemoterapia). Guía IDEaL. Guía de recomendaciones para la identificación y derivación temprana de pacientes con linfoma no Hodgkin de células B candidatos a terapias CAR-T. 2024.
12. Arganda C. CAR-T ambulatorio: misma eficacia y seguridad, con más eficiencia y calidad de vida | @diariofarma [Internet]. diariofarma. 2025 [citado 30 de diciembre de 2025]. Disponible en: https://diariofarma.com/2025/10/17/car-t-ambulatorio-misma-eficacia-y-seguridad-con-mas-eficiencia-y-calidad-de-vida